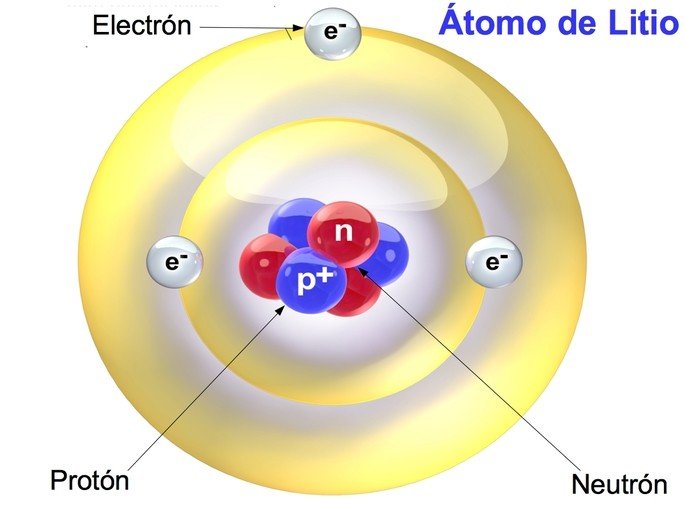
✅ El número atómico es la cantidad de protones en un núcleo, mientras que la masa atómica es el promedio ponderado de masas de sus isótopos.
La relación entre número atómico y masa atómica es fundamental en el estudio de la química, ya que estos dos conceptos son esenciales para entender la composición y las propiedades de los elementos químicos. El número atómico de un elemento, que se representa con la letra Z, indica la cantidad de protones presentes en el núcleo de un átomo, lo cual también determina su identidad química. Por otro lado, la masa atómica, que se expresa en unidades de masa atómica (uma), es el promedio ponderado de las masas de todos los isótopos de un elemento, tomando en cuenta su abundancia natural. En general, la masa atómica suele ser mayor que el número atómico debido a la presencia de neutrones en el núcleo.
Para entender mejor esta relación, es importante destacar que la masa atómica se puede calcular considerando tanto los protones como los neutrones, ya que ambos contribuyen significativamente a la masa total del átomo. La fórmula básica para calcular la masa atómica es:
Fórmula de la masa atómica
Masa atómica = Número de protones + Número de neutrones
Por ejemplo, el carbono tiene un número atómico de 6 (6 protones) y su masa atómica es aproximadamente 12.01 uma, lo que indica que, en promedio, tiene alrededor de 6 neutrones (12 – 6 = 6). Esta relación se repite en muchos otros elementos de la tabla periódica, donde la masa atómica varía debido a la existencia de isótopos, que son átomos del mismo elemento con diferente número de neutrones.
Isótopos y su impacto en la masa atómica
La existencia de isótopos afecta la masa atómica de los elementos. Por ejemplo, el hidrógeno tiene tres isótopos: el protio (1 protón, 0 neutrones), el deuterio (1 protón, 1 neutrón) y el tritio (1 protón, 2 neutrones). La masa atómica del hidrógeno es aproximadamente 1.008 uma, un valor que se debe a la mezcla de estos isótopos en la naturaleza. Esta variación en los isótopos y sus respectivas abundancias es lo que crea diferencias en las masas atómicas de los elementos.
- Protones: Aportan carga positiva y definen el elemento.
- Neutrones: Aportan masa, pero no carga.
- Electrones: Aportan carga negativa, pero tienen muy poca masa comparado con protones y neutrones.
La relación entre el número atómico y la masa atómica es clave para comprender la composición de los átomos y cómo se comportan en reacciones químicas. A lo largo de este artículo, profundizaremos en ejemplos específicos y en cómo estas propiedades afectan las características de los elementos y su comportamiento en diferentes contextos químicos.
Cómo se determina el número y la masa atómica de un elemento
La determinación del número atómico y la masa atómica de un elemento es fundamental en la química, ya que ambos conceptos son clave para entender la estructura de la materia. A continuación, se describen los métodos y principios utilizados para calcular estas propiedades.
Número atómico
El número atómico (Z) de un elemento representa la cantidad de protones presentes en el núcleo de un átomo. Este número no solo define la identidad del elemento, sino que también determina su posición en la tabla periódica.
- Por ejemplo, el hidrógeno (H) tiene un número atómico de 1, lo que indica que posee un protón.
- En cambio, el carbono (C) tiene un número atómico de 6, lo que significa que tiene seis protones en su núcleo.
Masa atómica
La masa atómica es una medida de la masa promedio de los átomos de un elemento, considerando la abundancia de sus isótopos. Se expresa en unidades de masa atómica (uma) y se obtiene a través de varios métodos, los más comunes son:
- Espectrometría de masas: Este método permite separar y medir la masa de los diferentes isótopos de un elemento. A través de esta técnica, se puede calcular la masa atómica con gran precisión.
- Promedio ponderado: La masa atómica se calcula considerando la proporción de cada isótopo en la naturaleza. Por ejemplo, el cloro (Cl) tiene dos isótopos principales: Cl-35 y Cl-37. La masa atómica promedio de Cl es aproximadamente 35.45 uma, que se obtiene al ponderar la masa y abundancia de cada isótopo.
Ejemplo de cálculo de masa atómica
Supongamos que un elemento tiene dos isótopos:
| Isótopo | Abundancia (%) | Masa (uma) |
|---|---|---|
| Isótopo A | 75 | 10 |
| Isótopo B | 25 | 12 |
El cálculo de la masa atómica promedio sería:
Masa atómica = (0.75 * 10) + (0.25 * 12) = 10.5 uma
Relevancia de la masa atómica y el número atómico
Estos dos conceptos son cruciales para la química y tienen múltiples aplicaciones, como en la estereometría, donde se calcula la proporción de reactantes y productos en las reacciones químicas. Comprender el número y la masa atómica permite a los científicos:
- Predecir la reactividad de los elementos.
- Clasificar y organizar los elementos en la tabla periódica.
- Establecer relaciones entre diferentes compuestos y sus propiedades físicas y químicas.
Preguntas frecuentes
¿Qué es el número atómico?
El número atómico es la cantidad de protones en el núcleo de un átomo, y determina la identidad del elemento químico.
¿Qué es la masa atómica?
La masa atómica es la masa promedio de los átomos de un elemento, teniendo en cuenta la abundancia de sus isótopos.
¿Cómo se relacionan el número atómico y la masa atómica?
El número atómico fija el tipo de elemento, mientras que la masa atómica varía dependiendo de los isótopos presentes en la naturaleza.
¿Por qué es importante entender esta relación?
Es fundamental para comprender las propiedades químicas y físicas de los elementos y su comportamiento en reacciones.
¿Puede cambiar el número atómico de un elemento?
No, el número atómico es único para cada elemento y no cambia, aunque pueden formarse isótopos con masa atómica diferente.
Puntos clave sobre la relación entre número atómico y masa atómica
- El número atómico se representa con la letra “Z”.
- La masa atómica se representa comúnmente en unidades de masa atómica (uma).
- El número atómico influye en la ubicación del elemento en la tabla periódica.
- La masa atómica se calcula a partir de la masa de los isótopos y su abundancia relativa.
- Elementos con el mismo número atómico tienen propiedades químicas similares.
- Los isótopos de un elemento tienen el mismo número atómico pero diferente masa atómica.
¡Dejanos tus comentarios sobre este tema y no te olvides de revisar otros artículos de nuestra web que también podrían interesarte!